Science:利用人工智能揭示蛋白质稳定性规则,有望推进蛋白质工程变革
来源:生物谷原创 2025-07-29 09:24
蛋白质稳定性遵循的规则比之前认为的更简单,这一证实可以大幅减少蛋白质设计的试错阶段,为开发具有医疗或工业应用的蛋白质(如更环保的催化剂或更持久的药物)节省大量时间和精力。
蛋白质是生命的分子主力,从将阳光转化为食物到对抗病毒,它们无所不能。它们由20种不同类型的氨基酸分子构成,因此,即使是一个由60个氨基酸组成的小蛋白质,理论上也可以有10的78次方(quinquavigintillion)种不同的构建方式。这大约相当于整个宇宙中的原子数量。
进化是如何从这海量的组合中筛选出那些能够折叠、保持稳定并完成工作的蛋白质的呢?我们能否学习这些规则来帮助蛋白质工程师设计更好的药物和更环保的催化剂?如今,一项在《科学》杂志上的研究,在回答这两个问题方面迈出了重要一步。
蛋白质有一个维持结构不塌陷的核心(core),而它的表面则完成大部分工作,例如与其他分子结合。几十年来,生物学家认为改变核心就像拆除承重墙:一步走错,整个结构就会坍塌。由于埋藏在内部的氨基酸紧密堆积,似乎任何改变都可能迫使邻近的氨基酸移位,导致不可预测的多米诺骨牌效应波及整个蛋白质。
根据这种经典的蛋白质稳定性观点,对蛋白质构成单元(指的是组成蛋白质的氨基酸)的大多数改变都会触发隐藏的陷阱,并威胁使整个结构变形。考虑到可能的组合数量如此庞大,进化偶然找到一条安全路径来创造新蛋白质的几率似乎微乎其微。
这项研究颠覆了这一观念。来自西班牙巴塞罗那基因组调控中心和英国维康桑格研究所的研究人员研究了一个名为FYN-SH3的人类蛋白质结构域(蛋白质的功能部分),制造了数十万个变体,并测试了哪些变体仍然能够折叠并工作。

“我们的数据挑战了蛋白质是脆弱的‘纸牌屋’的教条。支配其稳定性的物理规则更像是乐高积木(Lego)而非层层叠(Jenga),其中改变一个积木块就威胁到整个结构倒塌的情况是罕见的,而且——关键的是——是可以预测的,”论文第一作者、巴塞罗那基因组调控中心博士后研究员 Albert Escobedo 博士解释道。
该团队利用实验产生的大量数据来测试:从一种蛋白质中学到的规则,是否有助于解释自然界中存在的所有相关蛋白质的进化。他们将数据输入机器学习算法,这帮助他们创建了一个可以预测SH3序列是否能保持稳定的工具。
SH3结构域自大约10亿年前早期多细胞生物出现以来就一直在多样化。该团队将他们的模型与公共数据库中找到的覆盖整个生命树(包括细菌、植物、昆虫和人类)的51159个天然SH3序列进行了比较。该算法正确地标记了几乎所有的SH3结构域为稳定的,即使测试序列与人类版本的序列相似度不到四分之一(25%)。
“进化不必筛选整个宇宙的序列。相反,折叠的生化法则为自然选择创造了一个广阔而宽容的景观,” Escobedo 博士说。
对蛋白质工程的意义
目前的蛋白质工程领域依赖于公司筛选数千种只进行最小改动的蛋白质变体,每次只推进少量改动,这使得新酶、药物和疫苗的设计既缓慢又昂贵。
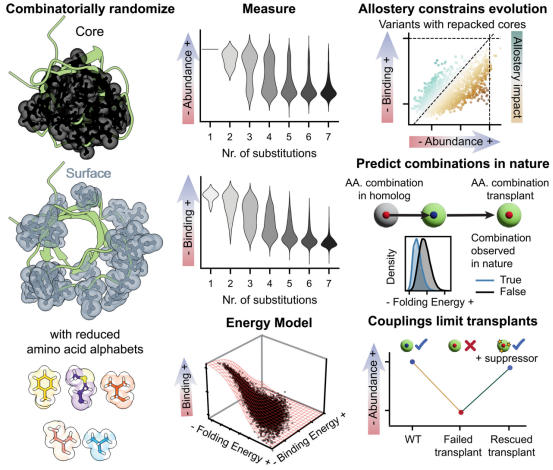
大规模随机化蛋白质核心和表面
蛋白质稳定性遵循的规则比之前认为的更简单,这一证实可以大幅减少蛋白质设计的试错阶段,为开发具有医疗或工业应用的蛋白质(如更环保的催化剂或更持久的药物)节省大量时间和精力。
例如,治疗性酶常常失败,因为它们的表面会引发免疫反应。重新设计这些蛋白质的表面是一项劳动密集型工作,需要大量的试错来避免结构塌陷并破坏一个有前景的设计。现在,蛋白质工程师可以在计算机上提出更大胆的设计,包括同时进行数十处修改,并且在走进实验室之前就已经知道哪些变体最有可能通过折叠和功能测试。
“预测和模拟蛋白质进化的能力为以工业速度设计生物分子打开了大门,挑战了蛋白质工程保守的步伐,”论文通讯作者、在巴塞罗那基因组调控中心和维康桑格研究所双重任职的 ICREA 研究教授 Ben Lehner 解释道。(生物谷Bioon.com)
参考文献:
Albert Escobedo et al, Genetics, energetics, and allostery in proteins with randomized cores and surfaces, Science (2025). DOI: 10.1126/science.adq3948.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


